轉錄組測序是利用第二代高通量測序技術(shù)快速獲取某一物種特定器官或組織在某一狀態(tài)下幾乎所有轉錄本的序列信息���,進(jìn)行疾病與正常樣本間的基因表達差異分析����、可變剪切和融合基因分析���,尋找與癌癥���、遺傳病相關(guān)的致病基因���,已廣泛應用于基礎研究���、臨床診斷和藥物研發(fā)等領(lǐng)域�。相對于傳統芯片而言�����,無(wú)需預先設計特異性探針���,具有分辨率高��、檢測范圍廣和準確率高的優(yōu)點(diǎn)�����。
實(shí)驗方案
測序策略:Illumina 平臺 PE150
數據量:6G/樣
技術(shù)優(yōu)勢
(1)任意物種檢測:相對于傳統芯片而言�����,無(wú)需預先設計特異性探針��,因此無(wú)需了解物種基因或基因組信息����,能夠直接對任何物種進(jìn)行最全面的轉錄組分析��;
(2)分辨率高:可以檢測基因家族中相似基因及可變剪接造成的單堿基差異���;
(3)檢測范圍廣:從幾個(gè)到數十萬(wàn)個(gè)拷貝精確計數�����,可同時(shí)鑒定正常和稀有的轉錄本��;
(4)信息分析全面:可以做基因差異表達分析�����、可變剪切�、融合基因分析���、新轉錄本預測及注釋��。
信息分析
標準信息分析
(1)按標準流程進(jìn)行數據整理及數據質(zhì)量評估����;
(2)與參考序列比對��,計算不同基因的RPKM值�����;
(3)基因的差異表達分析��;
(4)樣本間基因表達水平的相關(guān)性分析(僅限于有生物重復的樣本)��;
(5)樣本間差異基因韋恩圖及PCA分析����;
(6)差異基因的表達模式聚類(lèi)分析�����;
(7)差異表達基因GO功能富集分析�;
(8)差異表達基因Pathway顯著(zhù)富集分析���;
(9)差異表達基因的蛋白質(zhì)互作網(wǎng)絡(luò )分析���;
(10)條件特異表達���;
(11)鑒定基因的可變剪切�����;
(12)SNP/InDel分析�����;
(13)新轉錄本預測及注釋?zhuān)?/span>
(14)融合基因分析(僅限于人)�����;
高級信息分析
(1)基因結構優(yōu)化(只針對真核生物)
(2)RNA編輯
(3)差異基因的轉錄因子分析(適用于植物)
技術(shù)流程

轉錄組測序案例分析
案例(1)科學(xué)家繪制細胞周期的高分辨率轉錄組圖譜
細胞周期的推進(jìn)很大程度上依賴(lài)于周期性基因表達�。本研究繪制了細胞周期的高分辨率轉錄組圖譜����,揭示了周期性基因與癌癥之間的新關(guān)聯(lián)�����。研究人員在兩個(gè)連續的細胞周期中對人類(lèi)細胞進(jìn)行RNA測序����,鑒定了一千多個(gè)周期性表達的mRNA���、非編碼RNA和假基因�。研究顯示����,這些周期性轉錄本主要集中在與DNA代謝�、有絲分裂和DNA損傷應答有關(guān)的功能上�����。他們分析了癌癥基因組圖譜TCGA和其他數據庫的四千多個(gè)腫瘤樣本���,證實(shí)“有絲分裂特征”與遺傳改變�、腫瘤類(lèi)型和患者生存狀況有顯著(zhù)的關(guān)聯(lián)�����。研究人員還定義了67個(gè)核心基因����,這些基因在多種細胞中均有很強的周期性表達��。
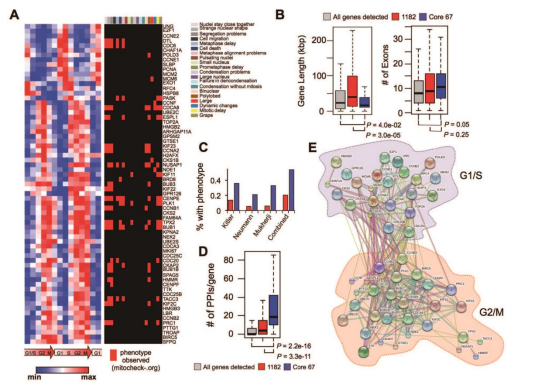
圖1 細胞周期核心基因的表達特征
案例(2)人類(lèi)組織和個(gè)體的轉錄組差異
轉錄調控和轉錄后加工影響許多細胞和器官的表型���?��;蛐徒M織表達(GTEx)項目通過(guò)RNA測序得到的數據探索個(gè)體和組織間的轉錄組類(lèi)型的變化差異�����。本研究從175個(gè)個(gè)體的43個(gè)身體部位采集得到1641份樣本���,包括29份器官組織�、11份腦亞區����、全血和兩份細胞系��。轉錄組測序數據表明�,平均每個(gè)樣本得到8千萬(wàn)比對到的片段數�����。尸體的組織樣本表現出帶有特點(diǎn)的并且穩定性強的轉錄組信號���。個(gè)體之間表現出高度基因表達差異���,包括不同性別����、種族和年齡的患病人群�����。原始轉錄是細胞特異性的主要驅動(dòng)因子��,后期剪切行使補充性角色��。差異剪切可能在鑒定個(gè)體表型中行使更加重要的作用�����。
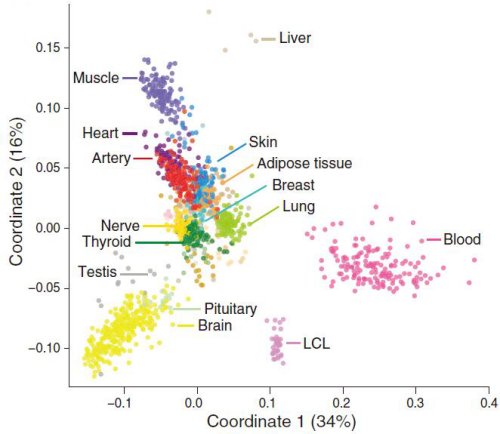
圖1 樣本和組織的表達譜相似性分析
案例(3)錫蘭鉤蟲(chóng)基因組和轉錄組的解析為藥物靶向奠定基礎
該研究針對致病性寄生蟲(chóng)錫蘭鉤蟲(chóng)基因組進(jìn)行了深度測序���,該寄生蟲(chóng)基因組大小約313Mb���。測序獲得了其每個(gè)生長(cháng)周期的轉錄組數據并進(jìn)行深度分析����,感染期共有30,738條基因表達�����。大約有900條基因在感染早期下調��?;谶@些測序數據���,研究者成功挖掘獲得錫蘭鉤蟲(chóng)生命周期中各節點(diǎn)處許多重要的功能基因信息�����,這些功能基因信息中存在能夠治療或阻斷錫蘭鉤蟲(chóng)引起致病性的重要靶向位點(diǎn)信息等���。
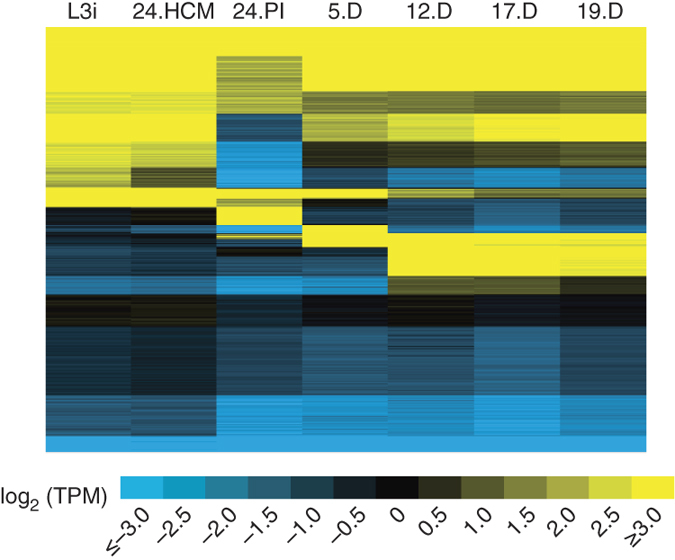
圖1 不同感染期的錫蘭鉤蟲(chóng)的基因表達差異情況
參考文獻
[1] Dominguez et al. A high-resolution transcriptome map of cell cycle reveals novel connections between periodic genes and cancer. Cell Research, 2016.
[2] Melé et al. The human transcriptome across tissues and individuals. Science, 2015.
[3] Schwarz et al. The genome and transcriptome of the zoonotic

![]()


